Column

暑い毎日が続いていますね。忙しい中でもお身体を大切に、ご自愛ください🍀
さて、今回はグラム染色についてです。
グラム染色にはいくつか種類があり、工程が少ないやり方や生体細胞と細菌の区別がしやすい方法などがあります。またグラム染色の染まりを良くするちょっとしたコツもありますので、解説していきます。
目次は以下の通りです。
(1)グラム染色とは 〜うんちく〜
(2)グラム染色とは 〜くわしく〜
(3)グラム染色の種類
(4)グラム染色のコツ
(1)グラム染色とは 〜うんちく〜
グラム染色法は1884年にデンマークの医師兼細菌学者ハンス・グラム先生が開発した方法です。組織をクリスタルバイオレットで染めてアルコールで脱色すると細菌(球菌)のみ染まるというのを偶然発見したそうです(感染してたのはグラム陽性球菌だったんですね)。
その後改良されて現在のグラム染色に至るわけですが原理は共通で、クリスタルバイオレットやビクトリアブルー(青)などで細胞壁を染めて脱色できるかを見ています。厚い細胞壁が一番外側にあるグラム陽性菌が染まり、外膜に保護された薄い細胞壁を持つグラム陰性菌は脱色されるので判別できます。

(2)グラム染色とは 〜くわしく〜
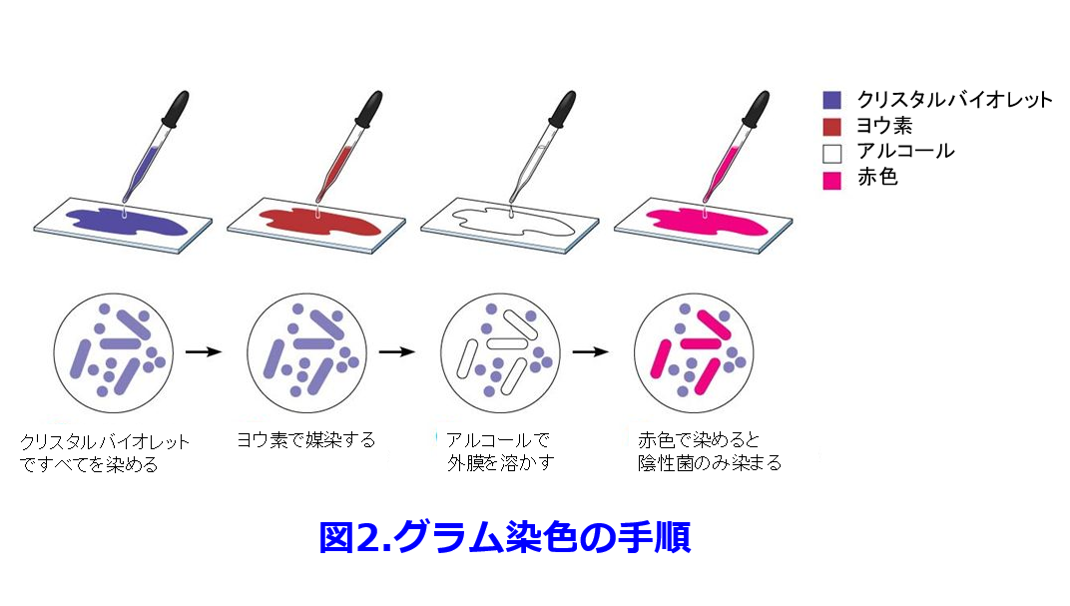
グラム染色には以下の4つの工程があります。
①前染色(細胞壁を染める)
②媒染(染まりを良くする)
③脱色
④後染色(特にグラム陰性菌が染まる)
①細胞壁の染色(細胞壁を染める)
先に説明した通り、この工程はクリスタルバイオレットやビクトリアブルーなどで細胞壁を青く染めます。グラム陽性菌は細胞表面に厚い細胞壁がありますので、バッチリ染まります。一方、グラム陰性菌は外膜があるので染まりにくい+細胞壁が薄いので染まりが弱めです。
②媒染(染まりを良くする)
クリスタルバイオレットではヨウ素、ビクトリアブルーではピクリン酸を加えると、複合体を形成して分子量が大きくなります。この複合体はアルコール不溶で、(かさばるので)菌体外へ出にくい状態となります。
③脱色
アルコールで色素を脱色します。基本的に細菌細胞はアルコールで壊れます(アルコール消毒できるのはこのため)。グラム染色ではアルコール処理が短時間なため細菌細胞が完全に壊れることはありませんが、痛みはします。アルコール脱色すると、グラム陽性菌は厚い細胞壁に②の複合体がキャッチされるためあまり脱色されません。一方、グラム陰性菌では薄い細胞壁しかありません(外膜はアルコールで容易に壊れる)ので、脱色が起こります。
④後染色(特にグラム陰性菌が染まる)
③の時点でスライドガラスを見ると、グラム陽性菌なら青、グラム陰性菌なら白となっています。これだと見にくいので、対比のため赤色の色素で後染色します。後染色ではグラム陰性菌だけでなく全体が染まりますので、グラム陽性菌は青→紫に染まるわけです。グラム陰性菌は脱色された細胞壁が再度染まるので、より赤く染まります。動物細胞も染色され薄い赤色に染まります(核は染まりやすいので赤色に染まりますが、グラム陰性菌と大きさが異なりますので、見分けることが可能です)。
(3)グラム染色の種類
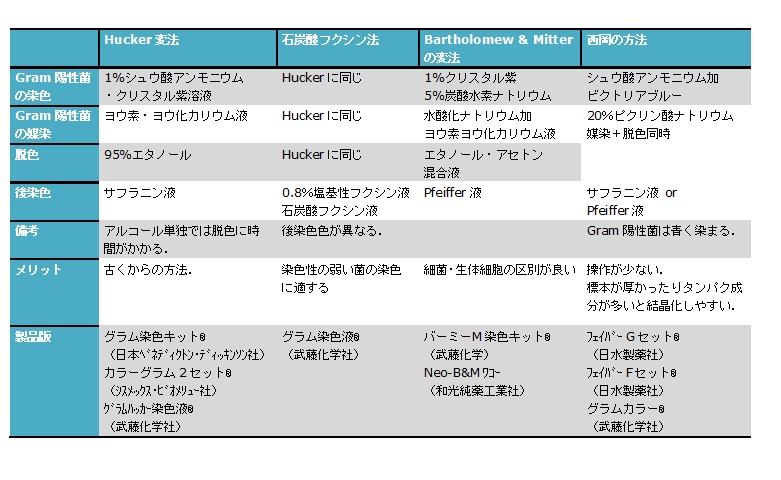
冒頭で記載した通り、グラム染色には以下の3種類があります。
A:Hucker(ハッカー)変法
B:Bartholomew & Mitter(バーミー)法
C:フェイバー法(西岡変法)
A:Hucker(ハッカー)変法
ハッカー法は最も古典的な手法です。故に手技が難しく、実施者による差が出やすいです。
・前染色…クリスタルバイオレット(色素)+1%シュウ酸アンモニウム(増強剤)
・媒染…ヨウ素・ヨウ化カリウム液(ルゴール液)
・脱色…エタノール(またはアセトン・アルコール)
・後染色…サフラニン液またはパイフェル液(フクシン液)※Campylobacterなどの難染色性細菌の染まりが良いため、パイフェル液が奨励されます。
B:Bartholomew & Mitter(バーミー)法
バーミー法は細菌と生体細胞の区別がしやすい手法です。
・前染色…クリスタルバイオレット(色素)+5%炭酸水素ナトリウム(増強剤)
・媒染…水酸化ナトリウム加ヨウ素・ヨウ化カリウム液
・脱色…エタノール・アセトン混合液
・後染色…パイフェル液(フクシン液)
C:フェイバー法(西岡変法)
フェイバー法では媒染液と脱色液があらかじめ混ざっているため、工程が1つ少なく時短になります。一方で、厚めの標本や蛋白質濃度が高い標本ではグラム陽性菌に似た顆粒が析出し、誤判定の原因となります。
・前染色…ビクトリアブルー(色素)+シュウ酸アンモニウム(増強剤)
・媒染・脱色…20%ピクリン酸ナトリウム(媒染液)+エタノール(脱色液)
・後染色…パイフェル液(フクシン液)またはサフラニン液
主にバーミー法とフェイバー法の使い分けになると思いますが、
細胞診でグラム陰性菌が見にくいならバーミー法
時短したいならフェイバー法
染まりが悪い菌なら後染色液をパイフェル(フクシン)液に変更
など適宜選択してお使いください♪
(4)グラム染色のコツ
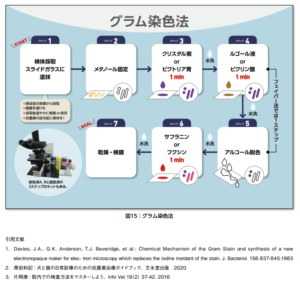
グラム染色の全体的な流れは「塗沫→乾燥→固定→前染色→水洗→媒染→水洗→脱色→水洗→後染色→水洗→乾燥→観察」ですね。グラム染色は(i)塗沫(ii)固定(iii)水洗後の溶液作用の3つのポイントを押さえるとより観察しやすくなります。
(i)塗沫
まず検体の塗沫は、薄くのばすのがコツになります。検体が厚く塗られていると、染色や脱色のムラができます。なるべく薄く伸ばし、観察時も厚い箇所ではなく薄い箇所を観察するのが良いでしょう。
(ii)固定
次に固定です。火炎固定とメタノール固定がありますが、実施者による差がでにくく、細胞診に適するのはメタノール固定です。乾燥標本をメタノールに1-2分浸し、乾燥させたら固定の完了です。どうしても火炎固定が良い方は、乾燥標本を「いーち、にー、さーん」とややゆっくりめに3回火に潜らせます。スライドガラスが熱くなっているので、少し冷ましてから染色に入ってください。
(iii)水洗後の溶液作用
最後に水洗後の溶液作用です。水洗すると当たり前ですが水滴が着きますよね。これが残っていると次に作用させる溶液が薄まって脱色・染色ムラができます。特に脱色時に水滴のせいで脱色不良が起こり、グラム陽性と誤判定することがありますので、ご注意ください。
水洗後よく水をきることと、溶液を一度捨ててもう一度作用させる※ことで標本の品質が向上します。(※例えば、脱色液をスライドガラスに一度載せ、素早く捨て、再度脱色液を載せることで薄まってない脱色液を作用させることができます)
ちょっとめんどくさいグラム染色ですが、パキッと染まると治療に大いに役立ちます。ぜひお役立てください。
※正しいグラム染色のお作法の図↓
参考:
1. 紺野昌俊. (2011). Paul EhrlichとHans Christian Gram (その3). モダンメディア 57巻11号2011 「臨床微生物学の「礎」を築いた人々」319
2. 小栗豊子. グラム染色の手技. 東京都臨床検査技師会.
(https://toringi.sakura.ne.jp/images/pdf/info/wsf-1.pdf)
3. 医学書院. (2014). 臨床検査 Vol.58 No.11
4. 農林水産省. (2020). 愛玩動物における抗菌薬の慎重使用の手引き
その他画像キャプションに記載